वैधुत रसायन

धनायन- जब कोई उदासीन परमाणु अपने इलेक्ट्रॉन त्याग देता है तो उस पर धनावेश आ जाता है अब वह परमाणु ना रह कर एक आयन बन जाता है जिसे धनायन कहते हैं विज्ञान की भाषा में धनायन को कैटआयन कहा जाता है हाइड्रोजन को छोड़कर शेष सभी धनायन धातु होते हैं याद करने का तरीका ध से धातु ध से धनायन
धातुएं आवर्त सारणी में पहले दो वर्गों में तथा बीच के सभी संक्रमण तत्व और आंतरिक संक्रमण तत्व के रूप में होते हैं तथा एक तिरछी लाइन से P ब्लॉक तत्वों में भी धातुएं होती हैं
ऋण आयन- जब कोई उदासीन परमाणु एक अथवा अधिक इलेक्ट्रॉन ग्रहण कर लेता है तब उस पर ऋण आवेश आ जाता है अब यह उदासीन परमाणु नहीं रह जाता बल्कि ऋण आयन बन जाता है सभी अधातुए ऋण आयन बनाते हैं ऋण आयन को एनआयन कहा जाता है
Note –
- जब कोई उदासीन परमाणु इलेक्ट्रॉन त्याग कर धनायन में परिवर्तित हो जाता है तो उसे ऑक्सीकरण अभिक्रिया कहते हैं
- जब कोई परमाणु इलेक्ट्रॉन ग्रहण करके ऋण आयन में बदल जाता है तो उसे अपचयन अभिक्रिया प्रक्रिया कहते हैं
ऑक्सीकरण तथा अपचयन की मूल अवधारणा ( Basic Concept of Oxidation and reduction )
इनमे से कुछ भी हो जाए अभिक्रिया ऑक्सीकरण ही रहेगी
परमाणु से इलेक्ट्रॉन का दूर जाना ( धनायन में बदलना या धनात्मक संयोजकता का बढ़ना ) जैसे Fe++ से Fe+++
- किसी विद्युत ऋणी पदार्थ का जुड़ना
- ऑक्सीजन का जुड़ना
- किसी कम विद्युत ऋणी पदार्थ का अधिकविद्युत ऋणी पदार्थ से प्रतिस्थापन हो जाना
- कुल मिलाकर – वाला दाहिना हिस्सा बढ़ जाना
- धनायन अथवा हाइड्रोजन का अलग होना
इनमे से कुछ भी हो जाए अभिक्रिया अपचयन ही रहेगी
परमाणु से इलेक्ट्रॉन का निकट आना ( ऋण आयन में बदलना या धनात्मक संयोजकता का घटना) ऋणात्मक संयोजकता का बढ़ना
जैसे Cl+e———->Cl-
- किसी विद्युत धनी पदार्थ का जुड़ना हाइड्रोजन का जुड़ना
- कुल मिलाकर + वाला बायां हिस्सा बढ़ जाना
जल की विद्युत रोधी प्रकृति ( Water Resistant Nature )
सामान्यतः जल एक ध्रुवीय यौगिक है जल H धनायन तथा OH ऋण आयन से बना होता है परंतु शुद्ध आसुत जल में दोनों के मध्य इतना मजबूत बंद होता है कि विद्युत धारा इस बंधन को तोड़ नहीं पाती और आसुत जल विद्युत धारा का कुचालक होता है
परंतु जैसे ही इसमें एक चुटकी नमक डाल दिया जाता है तो सोडियम धनायन और क्लोरीन ऋण आयन में बदल जाता है जो जल के Hधनायन और OH ऋणआयन को तोड़ देते हैं लिहाजा ऐसा जल विद्युत का चालक होता है
सामान्यता हमारे पीने वाले जल में कुछ खनिज पदार्थ आयनों के रुप में उपस्थित होते हैं जिसके कारण पेय जल विद्युत धारा का चालक होता है
आयनिक यौगिक- जब एक प्रबल धनायन किसीऋण आयन के साथ स्थिर विद्युत आकर्षण से बंध जाता है तो उसे आयनिक यौगिक कहते हैं लवण अर्थात नमक इसके सामान्य उदाहरण है लवण का बाया भाग धात्विक या कैटआयन (धनायन) के रूप में होता है जबकि दाहिना भाग एक अधातु के रूप में और एनआयन( ऋण आयन) के रूप में होता है ठोस अवस्था में यह योगिक विद्युत का चालन नहीं करते क्योंकि इनके आयन मजबूत प्रबल स्थिर विद्युत बल से बंधे होते हैं परंतु यदि से पिघला दिया जाए अथवा इसमें पानी डाल दिया जाए तब विद्युत धारा का चालन प्रारंभ हो जाता है
अर्थात आयनिक यौगिक केवल जलीय विलियन में घुलने पर अथवा पिघलाने पर ही विद्युत धारा प्रवाहित होने देते हैं ठोस अवस्था में यह भी विद्युत के कुचालक होते हैं
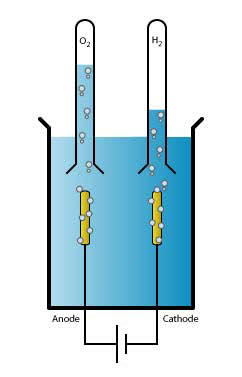
विद्युत अपघट्य ( Electrolyte )
जब किसी पात्र में कार्बन या प्लैटिनम के दो इलेक्ट्रोड लगा दिए जाएं और उसमें आसुत जल भर दिया जाए उस आसुत जल में थोड़ा सा अम्लीय लवण मिला दिया जाए तो इस प्रकार तैयार विलियन को विद्युत अपघट्य कहते हैं
जैसे ही इलेक्ट्रोड पर विद्युत धारा लगाई जाती है तो कैटआयन ( धनायन ), कैथोड ( ऋणात्मक इलेक्ट्रोड ) पर और एन आयन ( ऋणायन ) एनोड ( धनात्मक इलेक्ट्रोड ) पर एकत्र होने लग जाते हैं
वैधुत रसायन वैधुत रसायन